

Vol. 38 (Nº 47) Ano 2017. Pág. 22
Giovana Bomfim DE ALCANTARA 1; Marília Pereira MACHADO 2; Ricardo Augusto de OLIVEIRA 3; João Carlos BESPALHOK FILHO 4
Recebido: 29/05/2017 • Aprovado: 15/06/2017
RESUMO: O objetivo do presente trabalho foi avaliar o efeito de diferentes antioxidantes com a presença e ausência de luminosidade no controle da oxidação e multiplicação de três genótipos de cana-de-açúcar. O delineamento foi inteiramente casualizado, em esquema fatorial 5x2 (quatro antioxidantes, mais a testemunha na presença e ausência de luminosidade), com quatro repetições e cinco explantes por unidade experimental. Os antioxidantes diminuem a oxidação dos explantes. A luminosidade aumentou a oxidação, porém favoreceu a multiplicação de cana-de-açúcar. |
ABSTRACT: The objective of this study was to evaluate the effects of different antioxidants in the presence and absence of light in the control of oxidation and multiplication of three sugarcane genotypes. A completely randomized design in a factorial arrangement 5x2 (four antioxidants plus the control in the presence and absence of light), with 4 replicates and 5 explants per experimental unit was adopted. The antioxidants reduces the oxidation of explants. The light increase the oxidation, but favored the sugarcane multiplication. |
A cana-de-açúcar é usada na produção de 70% do açúcar mundial, e também é matéria-prima para a produção de álcool biocombustível. No Brasil, a área plantada de cana-de-açúcar ultrapassa 10 milhões de hectares, sendo o país maior produtor e exportador de derivados da cana-de-açúcar (UNICA, 2015).
Em decorrência da posição de destaque que ocupa na economia mundial, a cultura da cana-de-açúcar está frequentemente inserida em programas de melhoramento genético. Em programas de melhoramento genético da cana-de-açúcar, há necessidade, sob determinadas circunstâncias, de se multiplicar o material selecionado com rapidez. Neste sentido, técnicas de cultura de tecidos vêm sendo aplicadas na propagação das plantas, possibilitando a produção de mudas de boa qualidade, homogêneas e livres de doenças e pragas (Lee, 1984). A cultura de meristemas apresenta-se como uma possibilidade na obtenção de plantas de cana-de-açúcar sadias, garantindo estabilidade genética, produção de mudas durante o ano inteiro (Geijskes et al., 2003; Lakshmanan, 2006), e correspondendo a uma alternativa ao processo convencional de propagação vegetativa por meio de colmos. Altas taxas de multiplicação de cana-de-açúcar podem ser alcançadas por esse método, com inúmeras vantagens em relação à multiplicação em campo, como a produção de grande quantidade de mudas de qualidade superior, em tempo e espaço reduzidos (Malhotra, 1995).
Como a resposta morfogênica é fortemente influenciada pelo genótipo, é fundamental que seja realizada adaptação dos protocolos em cada cultivar a ser utilizada. Porém, o estabelecimento dos ápices caulinares em condições assépticas, durante o processo do cultivo de meristemas, é uma das fases mais críticas, em função da contaminação por fungos e bactérias e pela oxidação, caracterizada pelo escurecimento do ápice caulinar ou até mesmo do meio de cultivo (Grattapaglia, Machado, 1998).
A oxidação é causada pela reação das polifenoxidases sobre compostos fenólicos podendo levar os ápices caulinares à morte, nas fases iniciais de desenvolvimento ou prejudicar o desempenho da fase de multiplicação (Vuylsteke, Langhe, 1985), trazendo prejuízos significativos ao estabelecimento do material in vitro bem como na fase de multiplicação das brotações.
Estudos preliminares revelaram diferenças entre as cultivares de cana-de-açúcar em relação à intensidade de oxidação. A utilização de diversos antioxidantes é relatada na literatura, como alternativa para a diminuição do processo de oxidação in vitro. Grattapaglia & Machado (1998) recomendam a adição ao meio de cultivo ou o pré-tratamento com solução de antioxidantes, para diminuição da oxidação.
O objetivo deste trabalho foi avaliar o efeito de diferentes antioxidantes e do fator luminosidade no controle da oxidação durante a fase de multiplicação em três genótipos de cana-de-açúcar (duas cultivares e um clone), cultivadas in vitro.
O experimento foi conduzido no laboratório de micropropagação de plantas, Departamento de Fitotecnia e Fitossanitarismo do Setor de Ciências Agrarias da Universidade Federal do Paraná, Curitiba, Paraná.
Plantas de cana-de-açúcar, clone RB036152 e cultivares RB036091 e RB036066, fornecidos pela RIDESA(Rede Interuniversitária para o Desenvolvimento do Setor Sucroenergético), da Estação Experimental de Paranavaí foram utilizadas para os estudos. Folhas imaturas (cilindro de aproximadamente 2 x 10 cm) foram desinfestadas por 1 min em etanol 70% (v/v), enxaguadas três vezes com água destilada esterilizada, incubadas por 20 min em solução de 2,0% (v/v) de hipoclorito de sódio e enxaguadas três vezes em água destilada esterilizada. Segmentos transversais da região meristemática foram removidos e os meristemas foram isolados com o auxílio de um estéreomicroscópio em câmara de fluxo laminar.
Após o isolamento, os meristemas foram inoculados em meio de cultura MS (Murashige e Skoog, 1962) líquido, suplementado com 100 mg L-1 de mio-inositol, 0,1 mg L-1 de cinetina, 0,2 mg L-1 de 6-benzilaminopurina (BAP), 30 g L-1 de sacarose e 6 g L-1 de ágar. O meio foi autoclavado a temperatura de 121°C, a 1,5 atm, com pH ajustado para 5,8 antes da autoclavagem.
Os subcultivos foram realizados a cada 15 dias num total de cinco subcultivos, sendo que após este, os explantes foram transferidos para frascos vedados contendo 20 ml de meio MS já contendo os tratamentos definidos: 50 mg/l de Cisteína, 10 mg/l de Ácido ascórbico, 150 mg/l de Ácido cítrico e 1000 mg/l de polivilpirrolidona (PVP). As culturas foram mantidas a 25 ± 2 °C e foi avaliada também a ausência e presença de luminosidade, com densidade de fluxo de fótons de 30 mol.m-2.s-1 e fotoperíodo de 16 h.
O delineamento experimental utilizado foi inteiramente casualizado, em esquema fatorial 5x2 (quatro antioxidantes, mais a testemunha na presença e ausência de luz), com quatro repetições, sendo cada repetição composta por cinco explantes cada, os dados foram analisados por ANOVA e as médias comparadas pelo teste de Tukey (P < 0,05), utilizando o software Sisvar®(Ferreira, 2011).
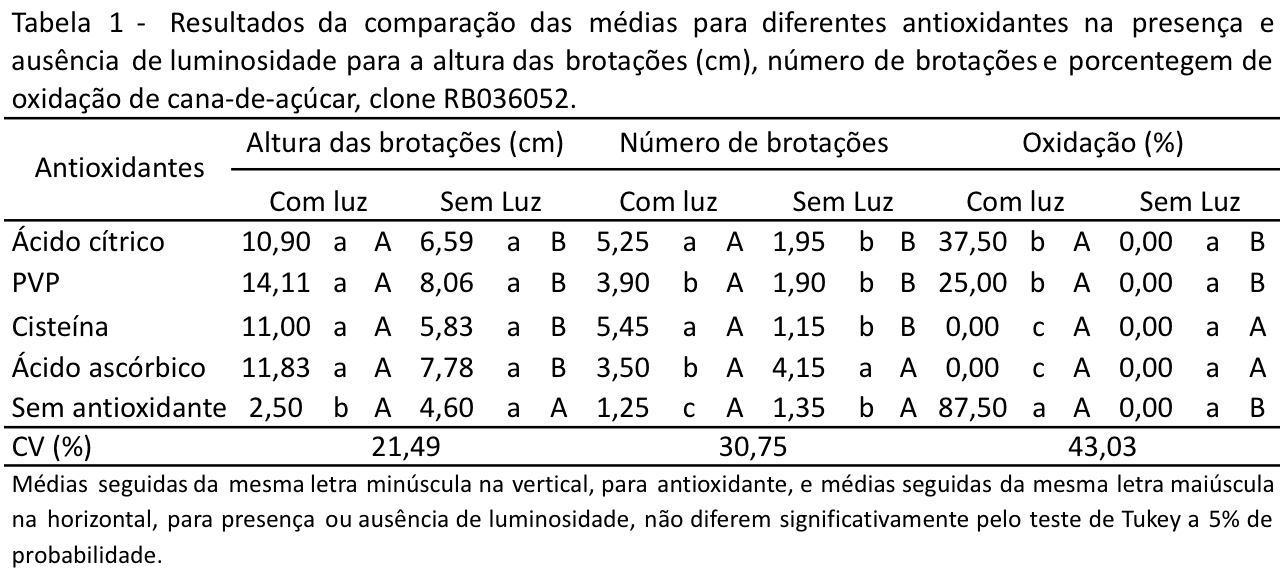
Com relação ao clone RB036052 todos os antioxidantes testados apresentaram resultados positivos para a variável altura das brotações, com diferença estatística quando comparado ao tratamento sem antioxidante, na presença de luminosidade. Entretanto não houve diferença estatística entre os quatro antioxidantes testados (Tabela 1).
Na ausência luminosidade os tratamentos com antioxidante também apresentaram alturas superiores comparados a testemunha, porém não houve diferença estatística entre os tratamentos. A luminosidade propiciou maior altura das brotações para todos os tratamentos com antioxidantes, com diferença estatística quando comparado aos tratamentos no escuro. Com a testemunha não houve diferença estatística na altura das brotações entre o tratamento com e sem luminosidade (Tabela 1).
Na presença de luminosidade os tratamentos com antioxidantes para o clone RB036052 também apresentaram os maiores números de brotações diferindo estatisticamente da testemunha. Dentre os antioxidantes que apresentaram os maiores números de brotações foram a cisteína seguida do ácido cítrico, não havendo diferença estatística entre esses dois antioxidantes, seguido pelos tratamentos com PVP e ácido ascórbico. O tratamento testemunha foi o que apresentou o menor número de brotações diferindo estatisticamente dos antioxidantes testados. Sem a luminosidade o maior número de brotações foi verificado com o ácido ascórbico diferindo estatisticamente dos demais tratamentos. Houve aumento no número de brotações com a luminosidade para os tratamentos com antioxidantes, com exceção do ácido ascórbico em que não houve diferença estatística no escuro e na presença de luz (Tabela 1).
Para o clone RB036052 na presença de luminosidade com a cisteína e o ácido ascórbico não houve oxidação. Já o ácido cítrico e o PVP tiveram uma porcentagem de oxidação intermediária (37,5 e 25%, respectivamente) e com a testemunha foi verificado uma alta porcentagem de oxidação (87,5%). Na ausência de luminosidade não houve oxidação para nenhum dos tratamentos. Diferente do observado no presente estudo não foi verificado efeito positivo da cisteína (125 mg L-1) no controle da oxidação no estabelecimento in vitro de inflorescência de bananeira (Alloufa et al. 2002).
A luminosidade propiciou em geral maior oxidação dos explantes para os tratamentos testados, com exceção da cisteína e do ácido ascórbico, os quais não apresentaram oxidação (Tabela 1). Estes resultados podem ser explicados pelo fato de que as enzimas da biossíntese de fenóis e da oxidação têm as atividades incrementadas na presença de luz (Davies, 1972). Neste sentido, para evitar a oxidação dos explantes algumas culturas in vitro são mantidas no escuro, principalmente nas fases iniciais do cultivo. Entretanto, embora o escuro tenha propiciado ausência ou baixa porcentagem de oxidação, os tratamentos com luminosidade foram os que apresentaram superioridade quanto a altura e o número de brotações o que justifica a importância dos estudos com agentes antioxidantes no meio de cultura. A luminosidade é um fator de grande importância no cultivo in vitro de plantas e seu controle tem influência direta na formação de brotações, no crescimento e na multiplicação dos explantes (Almeida, Mundstock, 2001).
Para a cultivar RB036066 na presença de luminosidade o PVP e o ácido ascórbico foram os que apresentaram as maiores alturas de brotações diferindo estatisticamente dos demais tratamentos, sendo que na ausência de antioxidante houve menor altura de brotações. Não houve diferença estatística para altura das brotações entre os tratamentos com e sem luminosidade, com exceção do PVP que a luz apresentou resultados favoráveis (Tabela 2).

Com relação ao número de brotações os tratamentos com antioxidantes apresentaram melhor resposta quando comparado a testemunha e dentre os antioxidantes testados o PVP, a cisteína e o ácido ascórbico foram os que responderam melhor, diferindo estatisticamente da testemunha. Com estes três tratamentos também foi verificada menor porcentagem de oxidação, sendo que com cisteína não houve oxidação. A maior porcentagem de oxidação foi verificada sem antioxidante. Na ausência de luminosidade os antioxidantes testados não apresentaram efeito para altura, número de brotações e porcentagem de oxidação. A luminosidade favoreceu o número de brotações para todos os tratamentos, com exceção do ácido cítrico e da testemunha, os quais não foram verificadas diferenças estatísticas quando comparada a ausência de luminosidade (Tabela 2).
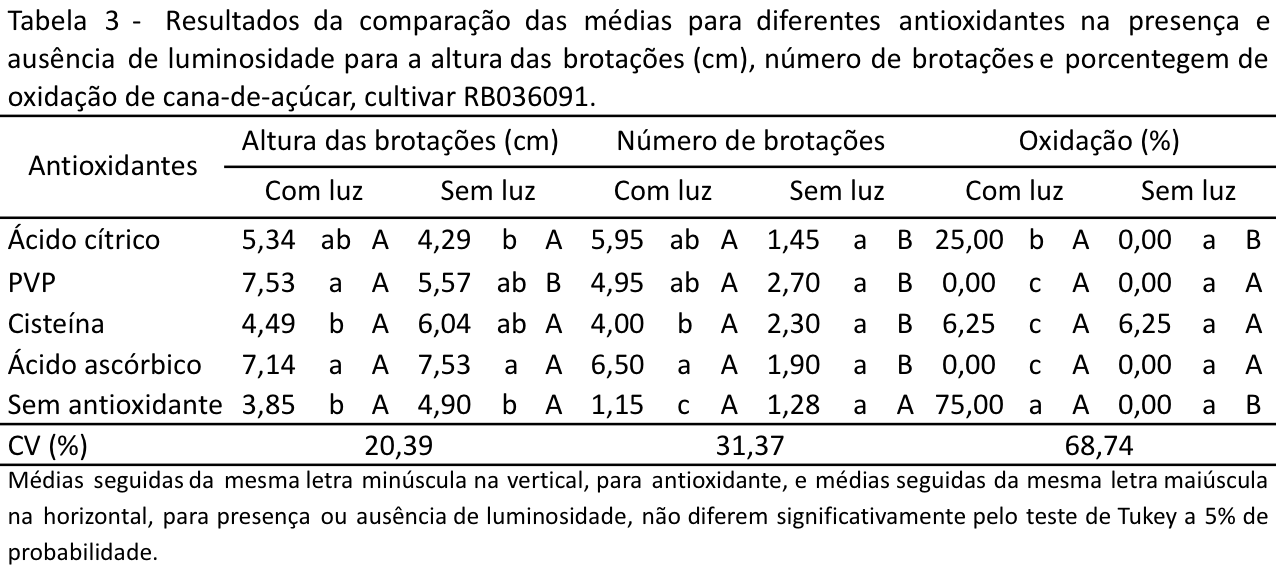
Para a cultivar RB036091 na presença de luminosidade o PVP e o ácido ascórbico, seguido do ácido cítrico foram os que apresentaram as maiores alturas de brotações, diferindo estatisticamente dos demais tratamentos. Na ausência de luminosidade o melhor tratamento para a altura de brotações foi o ácido ascórbico, diferindo estatisticamente da testemunha. Com exceção do PVP que a luminosidade favoreceu a altura das brotações os demais tratamentos não apresentaram diferença estatística entre presença ou ausência de luz (Tabela 3).
Com relação ao número de brotações o ácido ascórbico também foi o que apresentou melhor resultado na presença de luminosidade. Na ausência de luminosidade os antioxidantes não apresentaram influência no número de brotações, não havendo diferença estatística quando comparado com a testemunha. A luminosidade favoreceu o número de brotações para todos os antioxidantes testados, apresentando diferença estatística quando comparado aos tratamentos no escuro. A testemunha não apresentou diferença estatística na presença e ausência de luminosidade (Tabela 3). Em geral, a luminosidade apresentou efeito positivo para a multiplicação de cana-de-açúcar, avaliada pela altura e número de brotações. Esta maior taxa de multiplicação pode ser explicada pelo balanço endógeno de auxina/ citocinina presente nas gemas e por meio da interação entre a luminosidade e a auxina endógena. A maior intensidade luminosa pode estar reduzindo a concentração de auxinas endógenas, por meio da foto-oxidação, ocasionando um deslocamento do balanço hormonal em direção as citocininas, o qual poderia ter elevado a uma maior taxa de multiplicação (George, 1996). Corroborando com os resultados obtidos, em um estudo com ameixeira foi observado maior número e comprimento de gemas e brotos quando intensidades luminosas mais elevadas foram mantidas (Peters, Magalhães Jr., 1991).
Os antioxidantes diminuíram o índice de oxidação, sendo que na presença de luminosidade com o PVP e o ácido ascórbico não houve oxidação, porém com a testemunha a mesma chegou a 75%. A oxidação foi baixa na ausência de luminosidade para todos os tratamentos testados, não houve diferença estatística entre os tratamentos (Tabela 3). Muitas plantas apresentam dificuldades de estabelecimento in vitro, além da elevada taxa de contaminação, devido a oxidação em função da liberação de compostos fenólicos. O acúmulo de polifenóis modificam a composição do meio de cultura e por sua vez dificultam a absorção de metabólitos (Andrade et al., 2000). Desta maneira, a utilização de antioxidantes apresenta-se como uma alternativa para diminuir a oxidação. O antioxidante pode ser adicionado ao meio de cultura ou realizado um pré-tratamento dos explantes em solução com os antioxidantes (Grattapaglia e Machado, 1998, p. 183-260). Os fenóis são adsorvidos pelo PVP por meio de ligações de hidrogênio, o que previne a oxidação e polimerização, além de adsorver os produtos da oxidação fenólica (Pasqual et al., 1997). O PVP na mesma concentração testada no presente trabalho (1 g L-1) controlou a oxidação em amoreira-preta (Augusto, Biasi, 2002) e 0,5 g L-1 foi eficiente no controle da oxidação de Rollinia mucosa (Figueiredo, Albarello, Viana, 2001). O PVP reage com os compostos oxidantes e os ácidos cítrico e ascórbico reagem com os metais presentes no meio de cultura, não deixando com que estes fiquem disponíveis para se oxidarem (George, 1996).
De acordo com os resultados obtidos neste trabalho com cana-de açúcar, clone RB036052 e cultivares RB036066 e RB036091 conclui-se a utilização de antioxidante no meio cultura diminui a oxidação dos explantes. A resposta de cada antioxidante testado varia de acordo com o genótipo estudado. A luminosidade aumenta a taxa de oxidação, mas propicia maior taxa de multiplicação in vitro, evidenciado pelas variáveis altura e número de brotações.
Alloufa, M. A. I., Macêdo, C. E. C., Barroso, P. A. V., Barbalho, A. D., Oliveira, C. H. B. (setembro/ outubro, 2002). Avaliação de dois agentes antioxidantes no estabelecimento in vitro de inflorescências de bananeira (Musa spp). Ciência e Agrotecnologia, 26(5), 1092-1096.
Almeida, M. L., Mundstock, C. M. (maio/ junho, 2001). O afilhamento da aveia afetado pela qualidade de luz em plantas sob competição. Ciência Rural, 31(3), 393-400.
Andrade, M. W., Luz, J. M. Q., Lacerda, A. S., Melo, P. R. A. (january/ march, 2000). Micropropagação da aroeira (Myracrodruon urundeuva Fr. All). Ciência e Agrotecnologia, 24(1), 174-180.
Augusto, C. S. S., Biasi, L. A. (2002). Micropropagação da amoreira-preta cv. Brazos. Scientia Agraria, 3(1-2), 113-132.
Davies, M. E. (june, 1972). Polyphenol synthesis in cell suspension cultures of Paul’s Scarlet Rose. Planta, 104(6), 50-65.
Ferreira, D. F. (novembro/dezembro, 2011). Sisvar: a computer statistical analysis system. Ciência e Agrotecnologia, 35(6), 1039-1042.
Figueiredo, S. F. L., Albarello, N., Viana, V. R. C. (2001). Micropropagation of Rollinia mucosa (jacq.) Baill. In Vitro Cell Developmental Biology Plant, 37, 471-475.
Geijskes, R. J., Wang, L., Lakshmanan, P., McKeon, M. G., Berding, N., Swain, R. S., Elliott, A. R., Grof, C. P. L., Jackson, J. A., Smith, G. R. (2003). Smartsett™ seedlings: tissue cultured seed plants for the Australian sugar industry. Proceedings of the Australian Society Sugarcane Technology, 25, 13-17.
George, E. F. (1996). Plant propagation by tissue culture: the technology. 2. ed. Edington: Exegetics, 361 p.
Grattapaglia, D., Machado, M. A. 1998. Micropropagação. In: Torres, A. C., Caldas, L. S., Buso, J. A. Cultura de tecidos e transformação genética de plantas, v. 1.
Lakshmanan, P., Geijskes, R. J., Wang, L. W., Elliott, A., Grof, C. P. L., Berding, N., Smoth, G. R. (outubro, 2006). Developmental and hormonal regulation of direct shoot organogenesis and somatic embryogenesis in sugarcane (Saccharum spp. interspecific hybrids) leaf culture. Plant Cell Reports, 25(10), 1007-1015.
Lee, T. S., Bacchi, O. O. (1984). Improved rooting of differentiated shoots from sugarcane callus tissue. Turrialba, 34(4), 481-484.
Malhotra, S. D. (1995). Biotechnology and sugarcane. International Sugar Journal, 97, 160-163.
Murashige, T., Skoog, F. A. (julho, 1962). Revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiologia Plantarum, 15(3), 473-497.
Pasqual, M., Hoffmann, A., Ramos, J. D. (1997). Cultura de tecidos vegetais: tecnologia e aplicação. Lavras: UFLA.
Peters, J. A., Magalhães Jr., A. (outubro, 1991). Efeito do meio de cultura, tipo de lâmpada e intensidade de luz na multiplicação in vitro de ameixeira. Revista Brasileira de Fruticultura, 13(4), 41-48.
UNICA – União da Indústria de Cana-de-açúcar (2015). Histórico do setor sucroenergético. Recuperado de http://www.unica.com.br
Vuylsteke, D., De Langhe, E. (1985). Feasibility of in vitro propagation of bananas and plantains. Tropical Agriculture, 62(4), 323-328.
1. Professora do Departamento de Ciências Florestais, Setor de Ciências Agrárias, Universidade Federal do Paraná, Curitiba – PR. giobomfim@ufpr.br
2. Pós-doutoranda do Departamento de Fitotecnia e Fitossanitarismo, Setor de Ciências Agrárias, Universidade Federal do Paraná, Curitiba – PR.
3. Professor do Departamento de Fitotecnia e Fitossanitarismo, Setor de Ciências Agrárias, Universidade Federal do Paraná, Curitiba – PR.
4. Professor do Departamento de Fitotecnia e Fitossanitarismo, Setor de Ciências Agrárias, Universidade Federal do Paraná, Curitiba – PR.